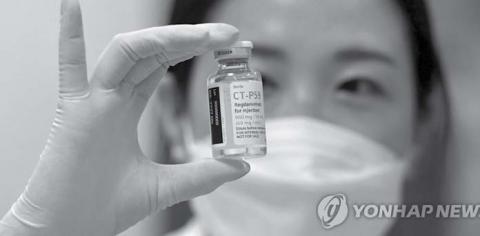
ကိုရီးယားသမ္မတနိုင်ငံ Celltrion Co., Ltd. က ထုတ်လုပ်သည့် COVID-19 Antibody Drug regdanvimab (သို့မဟုတ်) CT-P59 အတွက် ၂၉-၁၂-၂၀၂၀ ရက်တွင် အရေးပေါ် အသုံးပြုခွင့်ကို တင်ပြထားခဲ့မှု သည် သက်ဆိုင်ရာ ဝန်ကြီးဌာန၏ ရက် ၄၀ သုံးသပ်မှုကာလအတွင်း အတည်ပြုရန် အဆင့်အထိ ရောက်ရှိနေပြီဖြစ်ကြောင်း သိရှိရသည်။ ထို့ပြင် အခြားသော တောင်ကိုရီးယားအခြေ စိုက် ဆေးဝါးထုတ်လုပ်သည့် ကုမ္ပဏီဖြစ်သော Chong Kun Dang Pharm ကလည်း ၎င်းတို့ထုတ် လုပ်သည့် Nafamostat ဆေးဝါးသည် Clinical Phase 2 Trial ကို စမ်းသပ်ပြီးဖြစ်ကြောင်း၊ ရုရှားနိုင်ငံတွင် လူပေါင်း ၁၀ဝ ဦးဖြင့် စမ်းသပ်ခဲ့ရာ COVID-19 ရောဂါပြင်းထန်လက္ခဏာရှိ သည့် ၃၆ ဦးတွင် ၆၁ ဒသမ ၁ ရာခိုင်နှုန်း တိုးတက်မှုရလဒ် ရရှိခဲ့ကြောင်း၊ Nafamostat ဆေးဝါးကိုအသုံးပြု၍ ကုသခြင်းဖြင့် ပြန်လည်ကောင်းမွန်သည့် ရက် ကာလသည်လည်း ၁၄ ရက်မှ ၁၀ ရက်သို့ ကာလ လျှော့ချနိုင်ကြောင်း၊ Nafamostat သည် ရောဂါ ပြင်းထန်၍ အသက်ဆုံးရှုံးအံ့ဆဲဆဲလူနာကိုပင် ပြန်လည်ကောင်းမွန်နိုင်ကြောင်း၊ ၎င်းကုသဆေး အတွက် Phase 3 Trial စမ်းသပ်ချက်နှင့် အရေး ပေါ် အသုံးပြုခွင့် တင်ပြချက်များကို ၂၀၂၁ ခုနှစ်၊ ဇန်နဝါရီလအတွင်း သက်ဆိုင်ရာသို့တင်ပြလျှောက် ထားသွားမည်ဖြစ်ကြောင်း ကုမ္ပဏီ၏ထုတ်ဖော် ပြောကြားချက်အရ သိရှိရသည်။
တောင်ကိုရီးယားဆေးဝါးကုမ္ပဏီတစ်ခုဖြစ်သော GC Pharma ကလည်း ၎င်း၏ Blood Plasma-derived Treatment သွေးရည်ကြည်ကုထုံး အတွက် အရေးပေါ် အသုံးပြုခွင့်ကို သက်ဆိုင်ရာသို့ မကြာမီ လျှောက်ထားတင်ပြ သွား မည် ဖြစ်ကြောင်း၊ လူဦးရေ ၆၀ ဦးဖြင့် Phase 2 Trial အား စမ်းသပ်ပြီးဖြစ်ပြီး COVID-19 ရောဂါ လက္ခဏာဆိုးရွားသူ များကို ကုသပေးရန် ရည်ရွယ်ကြောင်းသိရသည်။ တောင်ကိုရီးယား ဆိုးလ်မြို့ အခြေစိုက် Daewoong Pharma-ceutical Co., Ltd. ကလည်း ၎င်း၏ Camostat ဆေးဝါးအတွက် Phase 3 Trial စမ်းသပ်ချက်များကို စတင်ဆောင်ရွက်နေပြီဖြစ်ပြီး အရေးပေါ် အသုံးပြုခွင့်ရရှိရေး အမြန်လျှောက်ထားမည်ဖြစ်ရာ ဈေးကွက်အတွင်း အမြန်ဖြန့်ချိနိုင် ရန် မျှော်လင့်ကြောင်း သိရသည်။ တောင်ကိုရီးယား ဆေးဘက်ဆိုင်ရာ သိပ္ပံ ကျောင်း ၃၅ ခု နှင့် ဆေးသုတေသနပညာရှင်၇၅ဦး တို့၏ တောင်းဆိုချက်အရ အဆိုပါ COVID-19 ကုထုံးဆေးဝါးများအတွက် အရေးပေါ် အသုံးပြု ခွင့် ခွင့်ပြုချက်ကို သက်ဆိုင်ရာဝန်ကြီးဌာန၏ သုံးသပ်မှုကာလ မပြည့်သေးမီတွင်ပင် Clinical Trial အဖြစ် အသုံးပြုခွင့်ပေးသွား ရန်ရှိကြောင်းThe Korea Disease Control and Prevention Agency (KDCA) မှ ၁၄-၁-၂၀၂၁ရက်တွင် ထုတ် ဖော်ပြောကြားခဲ့သည်။
Celltrion Co., Ltd. အနေဖြင့် ၎င်း၏ဆေး သည် ဗြိတိန်နိုင်ငံနှင့် တောင်အာဖရိကတို့မှ ကူးစက်ပျံ့နှံ့လာသော COVID-19 ကူးစက်ရောဂါ မျိုးစိတ်ကွဲများကို ကုသနိုင်ကြောင်း အထောက်အထားများနှင့် Phase 3 Clinical Trial ကို ဆက်လက်ဆောင်ရွက်ရန် လိုအပ်မည်ဖြစ်ကြောင်း၊ သို့ရာတွင် Celltrion Co., Ltd. က သက်ဆိုင်ရာသို့ ဦးစွာတင်ပြလျှောက်ထားခြင်းဖြစ်၍ Chong Kun Dang Pharm ထက် ခွင့်ပြုချက်ကို စော၍ရရှိနိုင်ကာ ကုသမှုဆောင်ရွက် ပေးမည်ဖြစ်ကြောင်း သိရှိရပါ သည်။ Celltrion ၏ ကုသဆေးသည် ရောဂါလက္ခဏာ အပျော့စားမှ အလယ်အလတ်အဆင့်ရှိ လူနာများကို ပိုမိုဆိုးရွားသောအဆင့်ထိ ရောက်မသွား အောင် တားဆီးပေးနိုင်ပြီး၊ အသက် (၅၀)အထက် လူနာများအတွက် စမ်းသပ်မှုတွင် ၆၈ ရာခိုင်နှုန်း တိုးတက်လာသည်ကို တွေ့ရှိရကြောင်း သိရှိရသည်။ အဆိုပါ COVID-19 ကုသဆေး စမ်းသပ် ချက်ရလဒ် ရာခိုင်နှုန်းများနှင့်ပတ်သက်၍ အချို့ ကလည်း ဝေဖန်မှုများရှိသော်လည်း တစ်ဖက်တွင် ယခုကဲ့သို့ တောင်ကိုရီးယားနိုင်ငံမှ တီထွင်ထုတ်လုပ်နိုင်မှုကို ဂုဏ်ယူလျက်ရှိကြသည်။ လက်ရှိတွင် တစ်ကမ္ဘာလုံးအတိုင်းအတာ အနေဖြင့်US Food and Drug Administration (US FDA) မှ COVID-19 ကုသဆေး အတွက် အရေးပေါ်အသုံးပြုခွင့်ရရှိထားသော ကုမ္ပဏီ များမှာ Eli Lilly နှင့် Regeneronတို့ဖြစ်ပါသည်။ တောင်ကိုရီးယားအခြေစိုက် Bukwang Pharm၊ Shin Poong Pharm၊ Crystal Genomix Dongwha Pharm နှင့် ImmuneMed Inc စသည့် ဆေးဝါးကုမ္ပဏီတို့သည် ၎င်းတို့၏ COVID-19ရောဂါကုသဆေးနှင့်ကုထုံးများအတွက် Clinical Trial စမ်းသပ်မှုများကို အသီးသီး ဆက်လက် ဆောင်ရွက်လျက်ရှိကြကြောင်း သိရှိရသည်။
ဝင်းပပသူ(စီးပွားရေးသံမှူး) မြန်မာသံရုံး၊ ဆိုးလ်မြို့။
